专家信息:
王艳丽,博士,中国科学院生物物理研究所研究员,博士生导师,中国科学院核酸生物学重点实验室创新课题组组长,中科院“**计划”获得者。
教育及工作经历:
2002-2004年,中国科学技术大学 博士。
2005—2006年,中国科学院生物物理研究所 助理研究员。
2006-2010年,美国斯隆-凯瑟琳癌症研究中心 博士后、副研究员、高级研究员。
2011年—至今,中国科学院生物物理研究所 “**计划”研究员,创新课题组组长。
2015-至今 中国科学院大学 教授。
主讲课程:
《表观遗传学》、《分子生物学》
培养研究生情况:
现课题组有2名博士,6名硕士。毕业的及仍在学的优秀的研究生不仅取得了丰硕的科研成果,还收获了一份份荣誉和奖励。迄今为止,已有多名学生获得国家奖学金、中国科学院院长奖学金、生物物理所所长奖学金、中国科学院大学大学生奖学金、中科院生物物理所所长论文奖等奖学金。
2015年一名博士生顺利毕业,该学生在本课题组作为第一作者在Nature上发表文章”Crystal structure of the RNA-guided immune surveillance Cascade complex in Escherichia coli”. Nature 2014,515,147-150。目前该名学生已赴洛克菲勒大学进行博士后工作。
招聘启事:
中国科学院生物物理研究所王艳丽课题组主要研究方向为: RNA沉默的结构生物学,通过研究基因沉默途径中的关键蛋白及复合物的结构与功能,阐明基因沉默的分子途径及分子机理;我们利用晶体学的方法结合生物化学、分子生物学以及细胞生物学等研究手段,开展核酸结合蛋白的结构与功能研究。具体的研究内容可以参考近期在《Nature》上发表的大肠杆菌Cascade的晶体结构。(http://www.nature.com/nature/journal/vnfv/ncurrent/full/nature13733.html)。
现因课题发展的需要,诚聘博士后一名,福利待遇参照生物物理所标准,具体视个人的研究背景和经历而定。
博士后
岗位职责:
1. 独立完成课题组长交给的科研任务或承担相关课题。
2. 协助课题组长在相关课题中指导研究生及实验室管理。
岗位要求:
1. 具有高度的责任心和上进心,性格乐观开朗,工作积极主动。
2. 具有生物学博士研究生学历、学位,具有结构生物学相关的研究背景。
3. 具有较强的英文阅读能力和中英文写作能力。
4. 热爱科研,富有合作精神,具有钻研精神和创新意识。
招聘办法:
请符合条件的申请者将个人简历、代表性论文的电子文本、三位推荐人的姓名及联系方式发至:ylwang (AT)ibp.ac.cn〔请将(AT)替换为@,防止垃圾邮件〕。邮件主题栏内请注明“博士后应聘”。经过初审后,我们将会通知应聘人员面试的具体时间、地点及相关事项。能胜任的申请者将按院及所规定提供有竞争力的薪酬。招聘自本通知发布之日起,直至位置填满为止。
研究方向:
(1)CRISPR/Cas系统的作用机理研究
CRISPR/Cas系统是源于细菌和古细菌的一种后天免疫系统,它是近年来发现的由小分子RNA介导的免疫系统。CRISPR/Cas广泛存在于原核生物中的一种由crRNA介导干扰系统,分为2大类。每一类包含不同的类型,其中,1类分为I型、III型、IV型;2类分为II型、V型、VI型。Ⅰ型CRISPR系统的crRNA加工成熟后,与多个Cas蛋白结合形成cascade 复合物,通过crRNA序列特异性地识别,并招募 Cas3蛋白对外源入侵核酸序列剪切。
本课题组成功解析了分辨率为3埃的E.coli Cascade复合物结构,揭示了由11个Cas蛋白以及一个61核苷酸的crRNA共同组成的分子量为405kDa的Cascade复合物的精确的组装方式,揭示了第一类中Ⅰ型CRISPR系统抗病毒的分子机理,同时也为进一步了解靶标的识别机制提供了新的信息(Nature, 2014)。我们发现了Cas1-Cas2识别外源入侵DNA分子机制,揭示了外源核酸片段的长度是如何确定的。该成果为揭示原核生物这一新的抵御病毒及遗传物质的入侵的机制奠定了重要的理论基础 (Cell, 2015)。通过解析AcrF3-Cas3复合物结构,我们阐明了anti-CRISPR 蛋白AcrF3对抗Ⅰ型CRISPR/Cas系统的作用机制,对病毒与宿主共同进化在分子层面提供了新的见解(Cell Res., 2016)。
我们还对第二类CRISPR进行了研究。解析了结合有sgRNA的C2c1晶体结构,发现目的序列的碱基突变显著降低C2c1切割活性,该研究结果有助于开发新的基因组编辑工具,降低基因编辑过程中的脱靶现象(Mol Cell, 2017);还解析了C2c2和C2c2-crRNA的晶体结构,发现C2c2结构不同于其它Cas蛋白,揭示了C2c2剪切pre-crRNA以及切割靶标RNA的分子机制,对理解细菌抵抗RNA病毒入侵的分子基础具有十分重要的意义;同时也为改造CRISPR-C2c2系统在基因编辑领域的运用提供了强有力的理论依据 (Cell, 2017)。
(2)小分子介导的基因沉默的结构生物学研究
RNA 干扰是由一个负责沉默作用的小RNA 分子(向导链)与Argonaute(Ago) 家族蛋白发生相互作用,这种RNA-Ago 蛋白复合体就构成了基因沉默复合体(RISC)里最基本的,也是最为核心的效应元件。在RISC 复合体中,小RNA分子通过碱基互补配对原则,以序列特异性的方式引导Ago 蛋白与靶标分子mRNA 结合。这些靶标分子mRNA 被Ago 蛋白识别之后会被切割或者翻译被抑制,最终被细胞降解。研究发现,有些微生物也具有Ago 蛋白,并具有真核生物类似的活性,但是其在原核生物体内的功能尚且不清楚。
在小分子RNA介导的基因沉默的过程中,探索Ago蛋白与向导链的构象变化,深入分析miRNA诱导基因沉默的机理。RNAi是指在进化过程中高度保守的、由双链RNA介导的特异性基因沉默现象。Argonaute (Ago)蛋白是RNA基因沉默途径中核心元件,其PIWI结构域能够催化引导链介导的mRNA的特异性降解。通过解析argonaute蛋白与引导链及靶RNA等复合物的结构,详细解释了argonaute沉默复合体参与调控基因沉默的具体途径和方式,阐明了其如何选择并切割RNA分子,最终降解RNA分子使基因沉默的过程。
我们发现某些原核生物的Ago蛋白不仅具有切割RNA的功能,还具有在小DNA分子介导下序列特异性的切割DNA的功能。通过解析系列的Ago蛋白与向导DNA以及靶DNA的三元复合物结构,我们揭示了Ago 蛋白切割DNA的分子机理 (PNAS, 2014)。
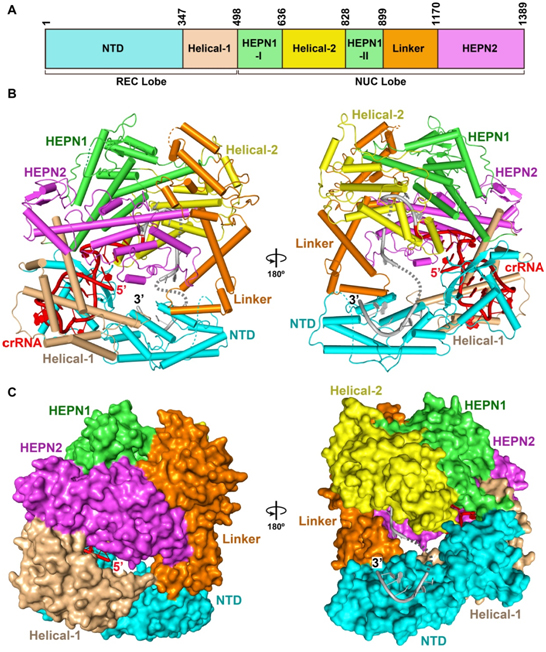
承担科研项目情况:
目前在研项目有:国家科技部973项目,“先天免疫相关蛋白质复合物结构与功能的研究”;国家自然基金委项目,“crRNA介导的免疫系统的结构与功能研究”;以及关于“超大分子复合物结构”等中科院项目。
科研成果:
1. 2015年成功解析了Cas1-Cas2与多种类型DNA的复合物的晶体结构,证明了被Cas1-Cas2所获取的外源核酸片段是以双叉的构象存在的;Cas1-Cas2通过两个酪氨酸固定并且准确量取双链部分,并以序列特异性的方式识别3’单链的中PAM的互补序列(5’-CTT-3’),由Cas1发挥活性作用,分别在两端的3’ overhang切割出5nt的长度,产生了一段33nt长度的DNA片段;在这个过程中,与外源核酸片段的结合,使得Cas1-Cas2经历了类似于蝴蝶飞舞时“翅膀上扬”到“翅膀水平“的构象变化,最终通过一种类似切割-拷贝的方式将获取的外源核酸片段插入到了自身的CRISPR位点。该研究发现了Cas1-Cas2识别外源入侵DNA分子机制,揭示了外源核酸片段的长度是如何确定的,同时也解释了该阶段中的核心蛋白Cas1和Cas2各自的功能。因此,该成果为揭示原核生物这一新的抵御病毒及遗传物质的入侵的机制奠定了重要的理论基础。
2. 2014年,成功解析了Cascade的高分辨率晶体结构。 通过研究发现,Cascade呈现出与冷冻电镜相似的“海马”结构。11个亚基形成两个结构层,6个CasC、CasD和CasE形成弓形的外层,并且6个CasC形成对称性的螺旋结构,CasE和CasA分别与两端的CasC相互作用。内层包括CasA和2个CasB,通过CasA-CasD相互作用以及与CasC侧面多个弱的接触位点结合。61个核苷酸的crRNA横跨Cascade的11个亚基,并与6个CasC亚基相互作用,5’和3’末端分别被CasD和CasE锚定。CrRNA的间隔区序列定位在CasC1-6亚基形成的连续的沟槽中。来自CasC2-6的5个长β发卡结构穿过crRNA。因此crRNA被分成5个片断,每个片段包括5个堆叠的碱基和一个翻转的碱基。每一个crRNA间隔区片断通过相似的方式与CasC相互作用。同期发表的Cascade复合物与单链靶DNA的晶体结构显示,crRNA与靶DNA不形成双螺旋,而是形成解旋不足的带状结构。
3. 解析了Argonaute蛋白与向导链的二元复合物结构,第一次鉴定了向导链的结合通道,阐明了向导链识别靶mRNA的分子机制;同时还解析了一系列的Argonaute蛋白与向导链以及靶mRNA的三元复合物结构,首次确定了靶链与向导链在 Argonaute 蛋白中的结合方式,阐明了Argonaute蛋白切割靶mRNA的分子机制。RIG-I蛋白在dsRNA病毒的固有免疫应答过程中发挥重要作用,王艳丽解析了RIG-I与5’-pppdsRNA的复合物机构,阐述了宿主通过RIG-I识别自身和病毒RNA的分子机制,为病毒的防御及治疗提供理论依据。
代表性论文:
1. Yin M, Wang J, Wang M, Li X, Zhang M, Wu Q, Wang, Y. Molecular mechanism of directional CTCF recognition of a diverse range of genomic sites. Cell Research, 2017, 27(11):1365-1377.
2. Liu L, Li X, Ma J, Li Z, You L, Wang J, Wang M, Zhang X, Wang, Y. The Molecular Architecture for RNA-Guided RNA Cleavage by Cas13a. Cell, 2017. 170(4):714-726.
3. Sheng G, Gogakos T, Wang J, Zhao, H, Serganov A, Juranek S, Tuschl T, Patel D, Wang, Y. Structure/cleavage-based insights into helical perturbations at bulge sites within T. thermophilus Argonaute silencing complexes. Nucleic Acids Res. 2017, 45(15):9149-9163.
4. Liu L, Li X, Wang J, Yin M, Chen P, Wang M, Li J, Sheng G, Wang Y. Two Distant Catalytic Sites Are Responsible for C2c2 RNase Activities. Cell. 2017,168:121-134.
5. Liu L, Chen P, Wang M, Li X, Wang J, Yin M, Wang Y. C2c1-sgRNA Complex Structure Reveals RNA-guided DNA Cleavage Mechanism. Molecular Cell. 2017, 65.
6. Swarts D, Szczepaniak M, Sheng G, Chandradoss S, Zhu Y, Timmers E, Zhang Y, ZhaoH, Lou J, Wang Y, Joo C and Oost J. Autonomous Generation and Loading of DNA Guides by Bacterial Argonaute,Molecular Cell, 2017, 65(6):985-998.
7. Wang J, Ma J, Cheng Z, Meng X, You L, Wang M, Zhang X, Wang, Y. A CRISPR evolutionary arms race: structural insights into viral anti-CRISPR/Cas responses. Cell Research. 2016, 26:1165–1168.
8. Wang, J., Li, J., Zhao, H., Sheng, G., Wang, M., Yin, M. & Wang, Y., Structural and Mechanistic Basis of PAM-Dependent Spacer Acquisition in CRISPR-Cas System. Cell. 2015, 163: 840-853.
9. Zhao, H., Sheng, G., Wang, J., Wang, M., Bunkoczi, G., Gong, W., Wei, Z. & Wang, Y. “Crystal structure of the RNA-guided immune surveillance Cascade complex in Escherichia coli”, Nature. 2014, 151: 147-150.
10. Swarts, D. C., Makarova, K., Wang, Y., Nakanishi, K., Ketting, R., Koonin, E., Patel, D. J. & Oost, van der, J., “The evolutionary journey of Argonaute proteins”, Nature structural & molecular biology, 2014, 21: 743-753.
11. Swarts, D. C., Jore, M. M., Westra, E. R., Zhu, Y., Janssen, J. H., Snijders, A. P., Wang, Y., Patel, D. J., Berenguer, J., Brouns, S. J.J. & Oost, van der, J. "DNA-guided DNA interference by a prokaryotic Argonaute", Nature, 2014, 507: 258-261.
12. Sheng, G., Zhao, H., Wang, J., Rao, Y., Tian, W., Swarts, D. C., van der Oost, J., Patel, D. J. and Wang, Y. "Structure-based cleavage mechanism of Thermus thermophilus Argonaute DNA guide strand-mediated DNA target cleavage." Proc Natl Acad Sci U S A.2014, 111(2): 652-657.
13. Rüdel S, Wang, Y, Lenobel R, K?rner R, Hsiao HH, Urlaub H, Patel D, Meister G. Phosphorylation of human Argonaute proteins affects small RNA binding. Nucleic Acids Res. 2011,39:2330-43.
14. Wang, Y., Ludwig J., Schuberth C., Goldeck M., Schlee M., Li H., Juranek S., Sheng G., Micura R., Tuschl T., Hartmann G., Patel D., Structural and functional insights into 5'-ppp RNA pattern recognition by the innate immune receptor RIG-I. Nat Struct Mol Biol. 2010, 17:781-7.. 2010, 17:781-7.
15. Wang, Y, Juranek S, Li H, Sheng G, Tuschl T, Patel DJ. Nucleation, propagation and cleavage of target RNAs in Ago silencing complexes. Nature. 2009, 461:754-761.
16. Wang, Y, Juranek S, Li H, Sheng G, Tuschl T, Patel DJ. Structure of an argonaute silencing complex with a seed-containing guide DNA and target RNA duplex. Nature. 2008, 56:921-926.
17. Wang, Y, Sheng G, Juranek S, Tuschl T, Patel DJ., Structure of the guide-strand-containing argonaute silencing complex. Nature. 2008, 456:209-213.
18. Wang, Y, Liu L, Wei Z, Cheng Z, Lin Y, Gong W. Seeing the process of histidine phosphorylation in human bisphosphoglycerate mutase. J Biol Chem. 2006, 281:39642-8.
19. Wang, Y, Wei Z, Liu L, Cheng Z, Lin Y, Ji F, Gong W. Crystal structure of human B type phosphoglycerate mutase bound with citrate. Biochem. Biophys. Res. Commun. 2005, 331:1207-15.
20. Wang, Y, Wei Z, Bian Q, Cheng Z, Wan M, Liu L, Gong W,Crystal structure of human bisphosphoglycerate mutase, J. Biol. Chem. 2004, 279: 39132-8.
课题组长所获奖项
1、2017年HHMI国际青年学者。
2、 2017年中国科学院优秀导师奖。
3、2016年第十三届中国青年女科学家奖。
4、2016年科技部“中青年领军人才”。
5、2016年第九届谈家桢生命科学奖(创新奖)。
6、细胞出版社2015中国年度论文奖。
7、2015年优秀百人奖。
8、2015年中国科学院优秀导师奖。
课题组学生所获奖励
1、2017年李雪岩、尹茂鲁获得研究生国家奖学金。
2、2016年李佳智获得中国科学院院长优秀奖。
3、2016年李佳智获得研究生国家奖学金。
4、2016年赵宏图获得中国科学院大学优秀毕业生奖。
5、2016年陈鹏获得中国科学院大学大学生奖学金。
6、2015年赵宏图获得中国科学院院长特别奖。
7、2015年赵宏图获得研究生国家奖学金。
8、2015年李佳智获得所长论文奖。
9、2014年赵宏图获得所长论文奖。
学术交流:
本课题组注重工作人员及学生培养,积极鼓励大家参加在非编码RNA领域的国内外重要会议。例如RNA Scoiety会议、CRISPR会议、 冷泉港会议及全国晶体学大会、全国核糖核酸(RNA)研讨会、中国生物物理学术大会等会议;
同时,本课题组定期邀请国内外专家到所内进行学术报告,并对本课题组人员课题进行指导。2015年邀请美国斯隆癌症纪念中心,美国两院院士Dinshaw J. Patel教授,美国乔治州立大学黄震教授等人到所内作贝时璋讲座。
王艳丽课题组揭示CRISPR获取新间隔序列的分子机制
2015年10月15日,Cell杂志在线发表了中科院生物物理研究所王艳丽研究组关于CRISPR-Cas系统中外源片段获取阶段的研究进展。标题为“Structural and Mechanistic
Basis of PAM-dependent Spacer Acquisition in CRISPR-Cas Systems”。本文揭示了Cas1-Cas2-PAM-DNA复合物等一系列复合物的晶体结构,证明了新间隔区获取依赖于
PAM的互补序列,并为该过程的作用机制提供了重要的结构生物学基础。
细菌和古菌等原核生物不断地遭受外界病毒的侵染以及水平核酸转移,成簇的且有规律间隔的短回文重复序列和它的辅助蛋白(Cas)构成了原核生物一个重要的免疫防御系统-
CRISPR/Cas系统。该防御过程主要包括三个阶段:(1)间隔区的获取,通过核心蛋白Cas1和Cas2的作用,来源于外源入侵的核酸片段(即Spacer)被获取,并插入到CRISPR位点。(2)crRNA表达,该片段被转录加工为成熟的crRNA,并与相关的Cas蛋白形成复合物。(3)crRNA干扰,成熟的crRNA引导RNA-Cas蛋白复合物识别携带有与该段序列互补的外源核酸,最终将其降解。crRNA表达和干扰两个阶段的分子及功能机制已经被揭示的非常透彻,而整个间隔区的获取过程却有待于更进一步的研究。
王艳丽研究组通过深入的研究,解析了Cas1-Cas2与多种类型DNA的复合物的晶体结构,证明了被Cas1-Cas2所获取的外源核酸片段是以双叉的构象存在的;Cas1-Cas2通过两个酪氨酸固定并且准确量取双链部分,并以序列特异性的方式识别3’单链的中PAM的互补序列(5’-CTT-3’),由Cas1发挥活性作用,分别在两端的3’ overhang切割出5nt的长度,产生了一段33nt长度的DNA片段;在这个过程中,与外源核酸片段的结合,使得Cas1-Cas2经历了类似于蝴蝶飞舞时“翅膀上扬”到“翅膀水平“的构象变化,最终通过一种类似切割-拷贝的方式将获取的外源核酸片段插入到了自身的CRISPR位点。该研究发现了Cas1-Cas2识别外源入侵DNA分子机制,揭示了外源核酸片段的长度是如何确定的,同时也解释了该阶段中的核心蛋白Cas1和Cas2各自的功能。因此,该成果为揭示原核生物这一新的抵御病毒及遗传物质的入侵的机制奠定了重要的理论基础。
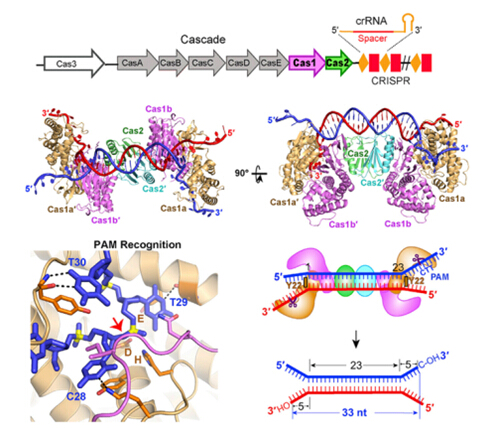
图注:E. coli Cas1-Cas2蛋白与具有双叉结构的间隔区前体DNA复合物的晶体结构。Cas1-Cas2特异性的识别并结合含有PAM互补序列DNA,进而确定间隔区前体的长度并将其插入到CRISPR-Cas位点。
王艳丽研究组的王久宇和李佳智(博士生)为本文的共同第一作者,该研究得到科技部、国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助,上海光源为该研究提供了重要的技术支持。
文章链接:http://www.cell.com/cell/abstract/S0092-8674(15)01321-5
来源:中国科学院生物物理研究所 2015-10-16
王艳丽研究组在Nature杂志上发表
CRISPR系统中Cascade复合物结构解析重要成果
2014年8月12日,Nature杂志在线发表了中科院生物物理研究所王艳丽研究组关于CRISPR系统中Cascade复合物的研究进展,标题为“Crystal structure of the RNA-
guided immune surveillance Cascade complex in Escherichia coli”。本文揭示了Cascade的晶体结构及其与RNA相互作用的方式。
成簇的、有规律间隔的短回文重复序列(clustered regularly interspaeed short palindromic repeats,CRISPR)和它的辅助蛋白(CRISPR-associated, Cas)构成
CRISPR/Cas系统,以一种类似于真核生物RNA干扰(RNAi)的作用机制,在原核生物抵抗入侵的噬菌体和质粒的防御系统中发挥着重要作用。CRISPR-Cas系统分为三个类型(I型,II型和III型),大肠杆菌CRISPR/Cas 系统属于I-E型,由5种Cas蛋白组成的11个亚基(其中含有1个CasA,2个CasB,6个CasC,1个CasD和1个CasE)以及一段61个核苷酸的成熟crRNA(CRISPR RNA)组成Cascade(CRISPR-associated complex for antiviral defense)复合物。Cascade复合物的质量约为405kDa,外观上呈现出近似于“海马”的结构,王艳丽研究组通过深入研究,获得了分辨率为3.05 Å的X射线晶体结构,详见下图:
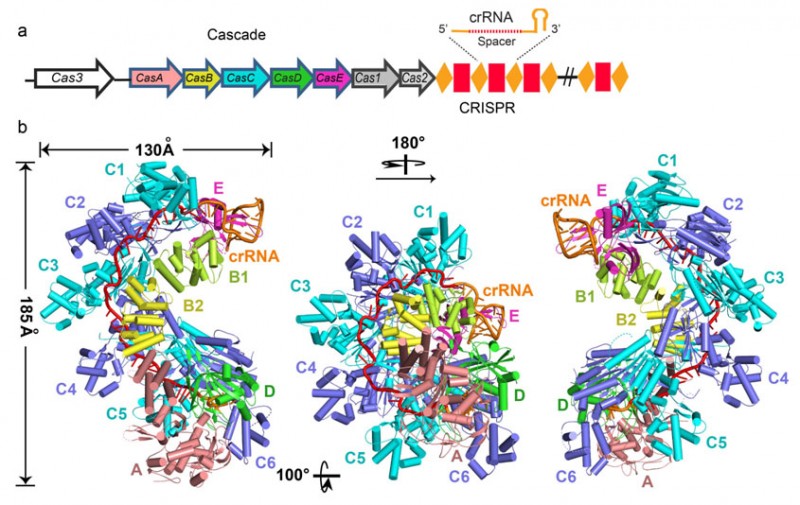
该结构显示,61个核苷酸的crRNA横跨Cascade的11个亚基,并与6个CasC亚基相互作用,5’和3’末端分别被CasD和CasE锚定。CrRNA的间隔区序列定位在CasC1-6亚基形成的连续的沟槽中。来自CasC2-6的5个长β发卡结构穿过crRNA。因此crRNA被分成5个片断,每个片段包括5个堆叠的碱基和一个翻转的碱基。每一个crRNA间隔区片断通过相似的方式与CasC相互作用。进一步的研究显示,crRNA不仅在靶点识别中发挥重要作用,而且也在Cascade的组装中发挥重要作用。本研究为Cascade如何发挥功能提供了重要依据。
王艳丽研究组的博士生赵宏图为本文的第一作者,该研究得到科技部、国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助,上海光源为该研究提供了重要的技术支持。
文章链接:http://www.nature.com/nature/journal/vnfv/ncurrent/full/nature13733.html
来源:中国科学院生物物理研究所 2014-08-13
2014年1月,王艳丽课题组在《Proceedings of the National Academy of the Sciences of the United States of America,PNAS》杂志发表题为“Structure-based
cleavage mechanism of Thermus thermophilus Argonaute DNA guide strand-mediated DNA target cleavage”的论文。该论文在结构生物学水平阐明了细菌的Agos蛋白指导导向DNA双链切割靶标DNA双链的机制。以上研究结果在分子生物学水平也证明了细菌通过Argonaute蛋白介导的DNA干扰机制来对抗转座子和可移动的遗传原件。
RNA沉默现象发现距今20年,对其机制的初解读到现在也仅10年,可是它的出现彻底揭示出生命体另一种基因表达调控方式,改变了人们原本认为非编码 RNA在体内不起关键作用的看法,也迅速成为人们研究的热点。随着 2006 年诺贝尔奖正式授予这一领域的研究成果,该领域的进展更是日新月异。通过对 RNA沉默机制的研究,人们发现了由不同小 RNA介导的 RNA 沉默通路,并鉴定了一系列参与 RNA沉默通路的关键蛋白。其中,RNA 诱导的沉默复合物 (RISC) 核心成分AGO蛋白日益成为人们研究的焦点。我们发现在原核生物中不仅存在RNA干扰,还存在着DNA介导的DNA沉默现象。
我们报道了三体嗜热杆菌Argonaute (TtAgo)三体蛋白和5’磷酸化的DNA,以及一系列天然靶标(互补的DNA片段)的复合物晶体结构。以上三元复合体结构在非活性状态、活性状态下的底物结合和底物被切割,取得了2.2 Å的分辨率,阐明了催化残基的定位机制。催化氨基酸和一对与可切割磷酸盐相关的Mg2+是通过Rnase H型机制进行TtAgo介导的靶标剪切所必需的。另外,这些三元体结构可以帮助理解通过蛋白质和DNA构象的改变来促进非活性状态和活性状态状态之间的转换,以及谷氨酸指在产生具有催化功能DEDD四聚体中的作用。剪切之后,剪切片段和互补的目的靶序列片段形成一个稳定的二聚体。
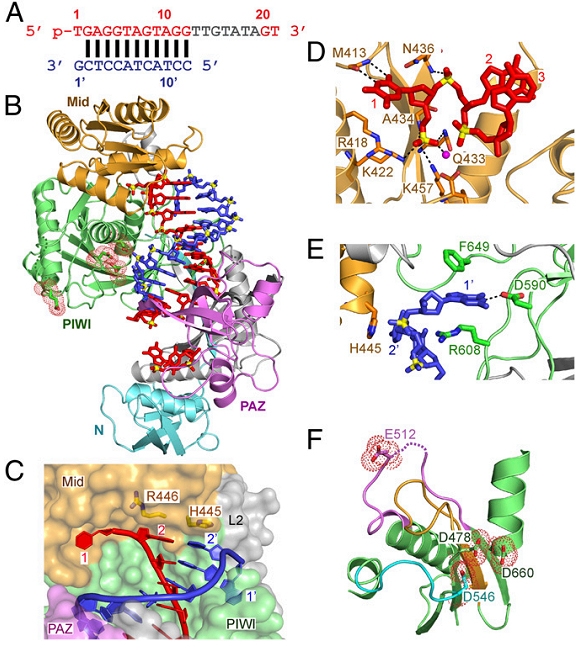
图示:TtAgo四体和引导DNA,以及靶标DNA形成的晶体结构,以及它们之间的相互作用。
盛刚、赵宏图为本文的共同第一作者。该研究的到了科技部,国家自然基金委和**计划的资助。
文章链接地址:http://www.pnas.org/content/111/2/652.long
来源:中国科学院生物物理研究所 2014-01-27
王艳丽:大自然的奇妙让我震撼
2014年8月12日,Nature杂志在线发表了题为Crystal structure of the RNA-guided immune surveillance Cascade complex in Escherichia coli的论文,该文章揭示了Cascade的晶体结构及其与RNA相互作用的方式,为阐释Cascade如何发挥功能提供了重要依据。CRISPR/Cas系统研究作为近几年被看好的冲击诺奖的强力候选领域之一,文章发表后,中国科学院生物物理研究所王艳丽研究组受到国际同行的瞩目。
在2010年入选“**计划”归国之前,王艳丽在日本和美国长期从事的正是RNA干扰机理方面的研究。2006年年初,她作为访问学者在美国佐治亚大学参与结构基因组的工作,后转入美国著名的斯隆-凯瑟琳癌症研究所从事RNA结合蛋白与RNA复合物的结构与功能研究,取得了多项重要研究成果。2008年、2009年她都以第一作者身份在Nature杂志上发表论文全文,另外一篇发表在2010年Nat Struct Mol Biol杂志上。具体成果包括:解析了Argonaute蛋白与向导链的二元复合物结构,第一次鉴定了向导链的结合通道,阐明了向导链识别靶mRNA的分子机制;同时还解析了一系列的Argonaute蛋白与向导链以及靶mRNA的三元复合物结构,首次确定了靶链与向导链在 Argonaute 蛋白中的结合方式,阐明了Argonaute蛋白切割靶mRNA的分子机制。RIG-I蛋白在dsRNA病毒的固有免疫应答过程中发挥重要作用,王艳丽解析了RIG-I与5’-pppdsRNA的复合物机构,阐述了宿主通过RIG-I识别自身和病毒RNA的分子机制,为病毒的防御及治疗提供理论依据。
2010年,王艳丽入选“**计划”,来到中科院生物物理所从事核酸结合蛋白与核酸复合物的结构研究。2014年,王艳丽课题组成功解析了Cascade的高分辨率晶体结构。而在此之前,借助于单颗粒冷冻电镜手段,研究人员只在2011年获得了Cascade复合物自身在8埃分辨率下的结构。总体来看,Cascade复合物质量约为405kDa,外观上呈现出近似于“海马”的结构,含有的组分包括有5种蛋白组成的11个亚单位以及一段61个核苷酸的成熟crRNA。
通过研究,王艳丽和同事们发现,Cascade呈现出与冷冻电镜相似的“海马”结构。11个亚基形成两个结构层,6个CasC、CasD和CasE形成弓形的外层,并且6个CasC形成对称性的螺旋结构,CasE和CasA分别与两端的CasC相互作用。内层包括CasA和2个CasB,通过CasA-CasD相互作用以及与CasC侧面多个弱的接触位点结合。61个核苷酸的crRNA横跨Cascade的11个亚基,并与6个CasC亚基相互作用,5’和3’末端分别被CasD和CasE锚定。CrRNA的间隔区序列定位在CasC1-6亚基形成的连续的沟槽中。来自CasC2-6的5个长β发卡结构穿过crRNA。因此crRNA被分成5个片断,每个片段包括5个堆叠的碱基和一个翻转的碱基。每一个crRNA间隔区片断通过相似的方式与CasC相互作用。同期发表的
Cascade复合物与单链靶DNA的晶体结构显示,crRNA与靶DNA不形成双螺旋,而是形成解旋不足的带状结构。
作为一支年轻的科研队伍,能在短时间内取得如此丰硕的成绩。王艳丽不无感慨。带领团队,她始终希望学生们和年轻的博士后能够发自内心的热爱自己所从事的工作。就如同她自己的经历一样,本是误打误撞进了大学生物系的他,慢慢地在实验室里感受到了大自然的奇妙。而她选择用“震撼”两个字来形容这种神奇,巧夺天工的设计让人不禁赞叹,同时也产生了尊重规律以及对于自然谦卑畏敬的心。
吃饭的时间根据实验的时间来确定、趁着仪器自动工作的空档赶紧扒拉两口是这个课题组的常态,为了保持试验温度加班加点一次完成更是“必备品项”。笑称自己做不了其他工作的王艳丽,并不认为国内实验室的水准低于国外。谈到如何管理团队,她更多地希望通过感染的方式传达这样的勤奋和态度。
尽管目前CRISPR/Cas的研究已经取得可喜的进展,但是Cas蛋白呈现高度的多样性,而且大部分蛋白的功能尚不清楚,而这些也正是王艳丽课题组未来努力的主要方向。这支年轻且充满活力积极向上的队伍将带来哪些惊喜,不禁让人拭目以待。
来源:科学中国人 2015年第6期
中国科技创新人物云平台暨“互联网+”科技创新人物开放共享平台(简称:中国科技创新人物云平台)免责声明:
1、中国科技创新人物云平台是:“互联网+科技创新人物”的大型云平台,平台主要发挥互联网在生产要素配置中的优化和集成作用,将互联网与科技创新人物的创新成果深度融合于经济社会各领域之中,提升实体经济的创新力和生产力,形成更广泛的以互联网为基础设施和实现工具的经济发展新形态,实现融合创新,为大众创业,万众创新提供智力支持,为产业智能化提供支撑,加快形成经济发展新动能,促进国民经济提质增效升级。
2、中国科技创新人物云平台暨“互联网+”科技创新人物开放共享平台内容来源于互联网,信息都是采用计算机手段与相关数据库信息自动匹配提取数据生成,并不意味着赞同其观点或证实其内容的真实性,如果发现信息存在错误或者偏差,欢迎随时与我们联系,以便进行更新完善。
3、如果您认为本词条还有待完善,请编辑词条。
4、如果发现中国科技创新人物云平台提供的内容有误或转载稿涉及版权等问题,请及时向本站反馈,网站编辑部邮箱:kjcxac@126.com。
5、中国科技创新人物云平台建设中尽最大努力保证数据的真实可靠,但由于一些信息难于确认不可避免产生错误。因此,平台信息仅供参考,对于使用平台信息而引起的任何争议,平台概不承担任何责任。

















